Originalbeitrag erschienen bei andrologen.info | andro.topics
Hintergrund/Zielsetzung
In 2015 forderte die Food and Drug Administration der USA die Testosteron-Vertriebsunternehmen auf, eine randomisierte klinische Studie durchzuführen, um die Auswirkungen einer Testosteronsubstitutionstherapie (TRT) auf die Inzidenz unerwünschter kardiovaskulärer Ereignisse (MACE) bei hypogonadalen Männern mittleren und höheren Alters mit entweder bereits bestehender Herz-Kreislauf-Erkrankung oder hohem Risiko für Herz-Kreislauf-Erkrankungen zu bestimmen. Um dieser behördlichen Vorschrift nachzukommen wurde die Testosterone Replacement Therapy for Assessment of Long-Term Vascular Events and Efficacy Response in Hypogonadal Men (TRAVERSE)-Studie konzipiert. Die TRAVERSE Prostate Safety-Teilstudie untersuchte die Wirkung von Testosterontherapie (TTh) auf die Inzidenz von Prostatakrebs, unerwünschten Prostataereignissen und LUTS in dieser Bevölkerung.
Patienten und Methoden
In die placebokontrollierte, doppelbinde randomisierte klinische Studie waren 5.246 Männer (45-80 Jahre alt) von 316 US-Studienzentren aufgenommen worden. Die Teilnehmer hatten 2 Testosteronwerte unterhalb von 300 ng/dl, hypogonadale Symptome und eine kardiovaskuläre Krankheit (KVK) oder ein diesbezüglich erhöhtes Risiko. Männer mit einer PSA-Konzentration >3,0 ng/ml und einem International Prostate Symptom Score (IPSS) >19 waren ausgeschlossen.
Die Teilnehmer wurden stratifiziert nach zurückliegender KVK und zu 1,62% Testosteron-Gel oder Placebo randomisiert. Der primäre Endpunkt für Prostatasicherheit war das Auftreten von als hochgradig eingestuftem Prostatakrebs. Sekundäre Endpunkte umfassten das Auftreten von jeglichem Prostatakrebs, akutem Harnverhalt, invasiver Prostataoperation, Prostatabiopsie und zusätzlicher pharmazeutischer Behandlung. Der Effekt der Intervention wurde anhand eines Cox-Regressionsmodells für bestimmte Zeitpunkte analysiert.
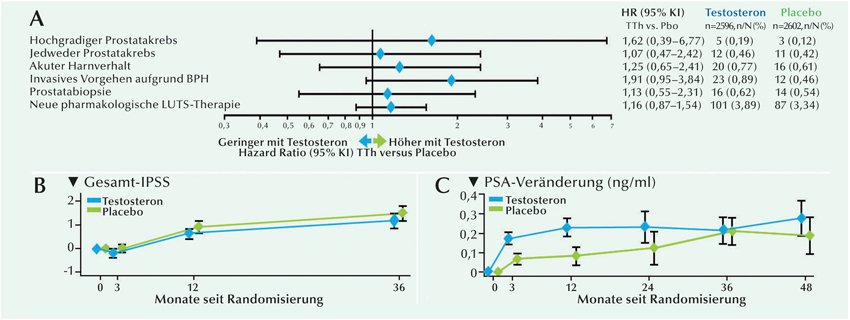
Abb.: Inzidenz primärer (hochgradiger Prostatakrebs) und sekundärer Endpunkte zur Prostatasicherheit: (A) hochgradiger Prostatakrebs, (B) Veränderung des IPSS über 36 Monate seit Baseline, (C) zeitabhängige Veränderung des PSA-Spiegels.
Ergebnisse
Im Verlauf von im Mittel 33 Monaten Follow-up (gleichzusetzen mit 14.304 Personenjahren) unterschied sich das Auftreten von hochgradigem Prostatakrebs nicht signifikant zwischen beiden Behandlungsgruppen: n=5/2596 (0,19%) in der TTh-Gruppe versus n=3/2602 (0,12%) in der Placebogruppe; HR 1,62 (95% KI: 0,39-6,77); p=0,51 (Abb. A). Die Inzidenz von Prostatakrebs jeglichen Grades, akutem Harnverhalt, invasiver operativer Behandlung von benigner Prostatahyperplasie, Prostatabiopsien und auch eine neue pharmakologische Behandlung von LUTS unterschieden sich zwischen den Behandlungsgruppen nicht signifikant (Abb. A).
Die Ergebnisse von Post-hoc-Sensitivitätsanalysen mittels eines Cox-Regressionsmodells waren denen der vorgegebenen Analysen insgesamt vergleichbar. Gleiches galt, wenn die Ereignisse nach 30 Tagen oder einem Jahr nach Beendigung der Behandlung zensiert wurden. Veränderungen des IPSS unterschieden sich zwischen den Gruppen nicht, und wiesen auf keinen signifikanten Unterschied beim Vorkommen von LUTS hin (Abb. B). Die PSA-Konzentration stieg bis zum 12. Behandlungsmonat bei den Männern mit Testosterontherapie stärker an als bei denen mit Placebo. Danach bestand zwischen den Gruppen kein signifikanter Unterschied bei den PSA-Spiegeln (Abb. C).
Kernaussagen
- In einem Kollektiv hypogonadaler Männer mittleren und höheren Alters, unter sorgfältigem Ausschluss derer mit einem hohen Prostatakrebsrisiko, war das Auftreten von hochgradigem oder jedwedem Prostatakrebs sowie anderer Prostatakrankheiten gering und unterschied sich nicht signifikant zwischen Testosteron- und Placebo-behandelten Männern.
- Die Befunde ermöglichen eine sachkundigere Einschätzung der potenziellen Risiken einer TRT.
Literatur:
Bhasin S, Travison TG, Pencina KM, et al. 2023. Prostate safety events during testosterone replacement therapy in men with hypogonadism a randomized clinical trial. JAMA Network Open 6:e2348692.