Originalbeitrag erschienen bei andrologen.info | andro.topics
Hintergrund
Patienten mit fortgeschrittenem Prostatakrebs (PCa) ohne angemessene kurative Behandlungsoption wird zumeist eine Androgendeprivationstherapie (ADT) verordnet. Für die ADT stehen mehrere Verfahren wie die chirurgische Kastration, die nichtsteroidale Antiandrogen (AA)-Monotherapie und die am häufigsten eingesetzten Gonadotropin-Releasing-Hormon (GnRH)-Agonisten zur Wahl. Jedwede Androgendeprivation ist von unerwünschten Effekten begleitet. So wurden für GnRH-Agonisten insbesondere Hitzewallungen, Gewichtszunahme, Libidoverlust und erektile Dysfunktion und metabolische Risiken beschrieben. Bei AA stehen Brustschmerzen und Gynäkomastie im Vordergrund. Aus einigen Untersuchungen geht hervor, dass GnRH-Agonisten mit einem höheren Nebenwirkungsrisiko behaftet sein könnten als die Antiandrogen-Monotherapie. Andererseits war nicht sicher, ob es sich dabei nicht um einen Indikationsbias handelt. Gleichwohl wurden ADTs bislang nicht bezüglich ihrer kumulierten Effekte auf die Gesamtkomorbidität miteinander verglichen.
Zielsetzung
Anhand von Daten eines bevölkerungsbasierten Registers wurde bei Männern mit fortgeschrittenem, nicht metastasiertem PCa die Rate an veränderter Komorbidität unter einer ADT mit GnRH-Agonisten versus Antiandrogen-Monotherapie verglichen.
Teilnehmer und Methoden
Aus der Prostate Cancer Database Sweden 3.0 wurden Männer mit fortgeschrittenem, nicht metastasiertem PCa identifiziert, die sich primär einer ADT entweder als AA-Monotherapie oder mit einem GnRH-Agonisten unterzogen hatten. In beiden Kollektiven wurden jedem Mann jeweils fünf vom Alter und der Regionalzugehörigkeit übereinstimmende Männer ohne PCa als Vergleichskohorte zugewählt. Die in einem Zeitraum von fünf Jahren vor bis fünf Jahre nach Beginn einer ADT angewachsene kumulative Komorbidität wurde mit dem Charlson Comorbidity Index (CCI) bemessen.
Ergebnisse
Die Studienpopulation umfasste 2.078 Männer mit AA-Monotherapie und 4.878 Männer mit GnRH-Agonisten zusammen mit 9.337 bzw. 21.808 Männer ohne PCa in den entsprechenden Vergleichskohorten. Die medianen Nachbeobachtungszeiten für die mit AA und die mit GnRH-Agonisten behandelten Männer betrugen 3,0 bzw. 3,7 Jahre.
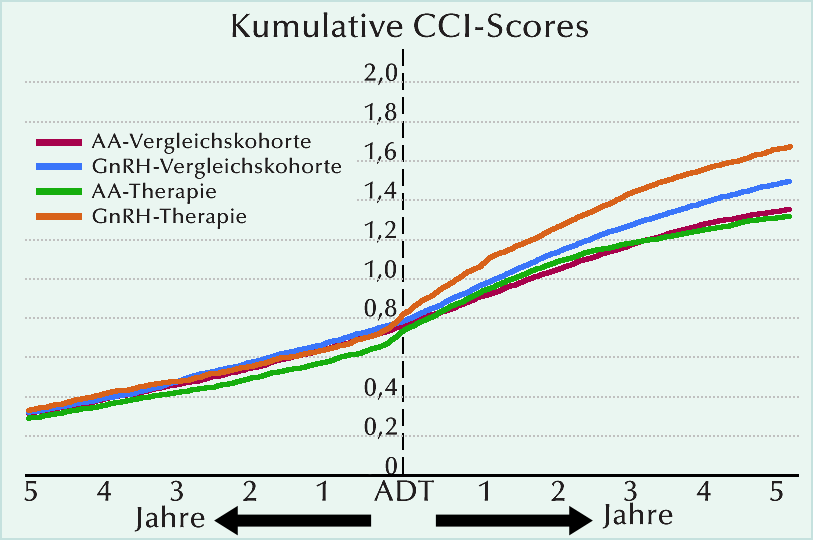
Die Veränderungen der mittleren kumulativen CCI sind für die vier Kohorten über ein 10-Jahre-Intervall in der Abbildung dargestellt. Es umfasst bei den Gruppen mit AA- oder GnRH-Therapie einen Zeitraum von fünf Jahren vor und fünf Jahren nach Beginn der jeweiligen ADT und bezieht sich bei den Vergleichskohorten auf einen parallelen Lebensabschnitt. Die Verläufe vor Einleitung der ADT gleichen sich bei den PCa-Patienten und den Vergleichskohorten weitgehend. Nach Beginn der ADT stieg der mittlere CCI in der AA-Kohorte in etwa parallel zu dem der in Vergleichskohorte an. Dagegen zeigt sich eine erhöhte Rate des CCI-Anstiegs bei den mit GnRH-Agonisten behandelten Männern gegenüber ihrer Vergleichskohorte. Eine multivariable Regressionsanalyse lässt erkennen, dass bei den Männern unter GnRH-Agonisten die Überschussrate der CCI-Veränderung nach Beginn der ADT höher ausfällt als bei Männern unter AA-Monotherapie (5,7% pro Jahr; p <0,001).
Das Muster der Krankheiten, die zu den CCI-Veränderungen beitragen, unterschied sich in den vier Gruppen vor ADT-Beginn kaum. Das änderte sich unter der ADT beachtlich: insbesondere für chronische Herzinsuffizienz (GnRH, 12%; AA, 6%) und Apoplex (GnRH, 10%; AA, 6%).
Anteil an den Veränderungen des CCI hatten insbesondere das Risiko für koronare Herzkrankheit (HR: 1,39; 95% KI, 1,14–1,69), Diabetes (HR: 1,64; 95% KI, 1,26–2,13) und Schlaganfall (HR: 1,26; 95% KI, 0,99–1,57) bei den Männern unter GnRH-Agonisten gegenüber denen unter AA. In der GnRH-Gruppe war auch das Demenzrisiko im Vergleich zur AA-Gruppe erhöht. Der Unterschied war allerdings nicht statistisch signifikant.