Welche Risiken birgt eine lokale Estrogen-Therapie?
Die metabolischen Effekte der Estrogene sind abhängig von Dosis, Applikationsweg und Estrogentyp. Die stärkste Wirkung übt Ethinylestradiol aus, gefolgt von konjugierten Estrogenen und Estradiol. Am geringsten wird der Stoffwechsel durch Estriol beeinflusst.
Von Unverträglichkeiten bei einer lokalen Estrogen-Therapie wird nur gelegentlich berichtet
Schwerwiegende Nebenwirkungen sind bei einer lokalen Estrogentherapie ausgesprochen ungewöhnlich. Allerdings können alle Präparate zu geringfügigen Nebenwirkungen wie vaginaler Reizung oder Jucken, vaginalem Ausfluss, vaginaler Blutung, Schmerzen im kleinen Becken, Mastodynien und Parästhesien führen1. Lokale Nebenwirkungen stellen jedoch die Mehrheit der berichteten unerwünschten Ereignisse dar2.
Die lokale Estrioltherapie als Behandlung der vaginalen Atrophie und anderer urogenitaler Beschwerden weist in aller Regel eine gute Verträglichkeit auf. In der Mehrzahl der zitierten Studien wurde festgestellt, dass die Behandlung mit estriolhaltigen Formulierungen (täglich 0,5 bis max. 1 mg) weder zu Behandlungsbeginn noch in der Folgebehandlung zu Beschwerden bei Patientinnen führte3,4,5,6.
In einer offenen multizentrischen Studie zur lokalen Verträglichkeit an 246 Patientinnen wurden 0,5 mg Estriol vaginal über 10 bis 14 Tage appliziert7. 50 % der Patientinnen litten unter Symptomen einer vaginalen Atrophie oder einer atrophischen Kolpitis und 10 % erhielten das Präparat im Rahmen der hormonellen Aufhellung (Zytodiagnostik). Die restlichen Frauen wurden aufgrund von Inkontinenzproblemen auch im Zusammenhang mit urogenitalen Operationen oder wegen einer trockenen Scheide und Dyspareunie behandelt. Die lokale Verträglichkeit erwies sich insgesamt als gut. Die Rate an Behandlungsabbrüchen wegen lokaler Unverträglichkeit (Brennen, Juckreiz) lag unter 3 %.
In anderen Studien wurde primär über schwache Nebenwirkungen wie leichte Übelkeit, kurzzeitiges lokales (vaginales) Brennen oder Hitzegefühl berichtet2,8,9,10,11. Diese Effekte traten vor allem zu Therapiebeginn auf, waren vorübergehend und erforderten keine Reduzierung der Dosis oder einen Abbruch der Behandlung. Sehr selten kann es zur Mastalgie kommen2, ab und an kann das Einführen der Ovula zu Schmerzen führen oder vulvovaginaler Juckreiz auftreten (Tab. 1)12.
Von ähnlichen Nebenwirkungen, sowie Kopfschmerzen und gastrointestinale Beschwerden wurde auch unter der Behandlung mit Estradiol-haltigen Präparaten (Ring oder Tablette) berichtet13,14,15.
Tabelle 1: Auftreten von Nebenwirkungen und unerwünschten Ereignissen bei Anwendung einer Estriol-Therapie (modifiziert nach Griesser et al. 2012)12
| 0,2 mg Estriol* | 0,03 mg Estriol* | Placebo* | Total* | |
|---|---|---|---|---|
| Behandelt | 142 (100,0) | 147 (100,0) | 147 (100,0) | 436 (100,0) |
| Mit UEs | 34 (23,9) | 32 (21,8) | 38 (25,9) | 104 (23,9) |
| Mit Nebenwirkungen | 21 (14,8) | 20 (13,6) | 23 (15,6) | 64 (14,7) |
| Vulvovaginales Brennen | 8 (5,6) | 10 (6,8) | 11 (7,5) | 29 (6,7) |
| Schmerz beim Einführen der Ovula | 3 (2,1) | 4 (2,7) | 5 (3,4) | 12 (2,8) |
| Vulvovaginaler Juckreiz | 2 (1,4) | 2 (1,4) | 4 (2,7) | 8 (1,8) |
| Mit schwerwiegenden UEs | 0 | 3 (2,0) | 2 (1,4) | 5 (1,1) |
| Mit schwerwiegenden Nebenwirkungen/Todesfälle | 0 | 0 | 0 | 0 |
* Jeweils Anzahl Patientinnen, in Klammern stehen Angaben in %.
Abkürzung: UEs = unerwünschte Ereignisse.
Wie sicher ist die vaginale Estrogen-Therapie in der Anwendung?
Andere beschriebene Nebenwirkungen unter Estrogentherapie beinhalten einen Anstieg des Risikos thromboembolischer Erkrankungen, eine Proliferation des Endometriums und eine leicht erhöhte Inzidenz an Brustkrebs. Allerdings wurden diese Effekte insbesondere nach systemischer Anwendung von pharmakodynamisch wirksameren Estrogenen beobachtet. Hierzu soll im Folgenden Stellung genommen werden:
Das Thromboembolierisiko steigt mit dem Alter, genetischer Prädisposition, erworbenen Risikofaktoren und der oralen Einnahme systemisch wirksamer Estrogene. Vaginal appliziertes Estrogen in üblichen Tagesdosen scheint hingegen keinen Einfluss auf das Gerinnungs- und Fibrinolysesystem auszuüben16. Grundsätzlich scheint das Risiko für die Entwicklung venöser Thrombosen bei parenteral verabreichtem Estrogen nicht oder nicht nennenswert erhöht zu sein17,18,19,20,21,22,23.
Der mögliche proliferative Effekt von Estriol und anderen Estrogenen auf das Endometrium ist von beträchtlichem klinischem Interesse und wurde in vielen Publikationen besprochen2,24,25,26. Weiderpass et al.27 konnten zeigen, dass eine vaginale Anwendung sogenannter „Niedrigpotenz-Estrogene“ (fast ausschließlich Estriol und Dienestrol in Tagesdosen von 0,5 mg) nach dem üblichen Anwendungsregime weder zu nennenswerter Endometriumproliferation noch gar zu Hyperplasie oder Karzinom führte. Aber auch für Estradiol-haltige Produkte legen Studien nahe, dass es aufgrund der geringen systemischen Absorption zu keiner signifikanten Stimulation des Endometriums kommt26,28,29. Lediglich für Cremes mit konjugierten Stutenestrogenen (nicht in DE erhältlich) wurde bisher eine Auffälligkeit in einer Metaanalyse beschrieben30.
Bei einer aktuellen Auswertung der WHI-Beobachtungsstudie mit 45.663 postmenopausalen Frauen zwischen 50 und 79 Jahren zu Studienbeginn wurde kein signifikant erhöhtes Risiko für Endometriumkarzinome bei dem Einsatz vaginaler Estrogene festgestellt. Je nach Adjustierungsmethode lag das Risiko bei 1,27 (95%-KI 0,69–2,33) oder 1,47 (95%-KI 0,75–2,9). Welche Estrogene zum Einsatz kamen, wurde bei der Studie nicht angegeben, jedoch sind in den USA vor allem vaginale Anwendungsformen mit Estradiol und CEE vorherrschend23.
Laut aktuellen Empfehlungen der Fachgesellschaften ist eine ergänzende Gestagentherapie bei einer niedrig dosierten vaginalen Estrogentherapie nicht notwendig, wobei es jedoch an randomisierten Studiendaten mit Beobachtungen länger als einem Jahr mangelt21,22. Daher sollten Frauen in der Postmenopause, die niedrig dosiertes Estrogen vaginal anwenden, bei auftretenden Blutungen gründlich untersucht werden. Auch die „European Menopause and Andropause Society“ gibt in ihrem Positionspapier an, dass bei lokaler Estrogenanwendung in den empfohlenen Dosierungen eine zusätzliche Gestagengabe zum Endometriumschutz nicht nötig ist31. Die europäischen Behörden fordern allerdings einen Gestagenzusatz oder eine Begrenzung der Anwendungsdauer bei lokalen Estrogenpräparaten, bei denen die normalen postmenopausalen Werte im Plasma nach Anwendung überschritten werden45. Ein Hinweis wird zukünftig in den entsprechenden Fachinformationen hinterlegt sein.
Bei dieser Entscheidung spielte möglicherweise die nationale dänische Kohortenstudie der Arbeitsgruppe von Lidegaard46 eine Rolle, die nur für kontinuierlich-kombinierte HRT-Präparate Endometriumsicherheit postulierte, während für alle anderen HRT-Formen, einschließlich vaginaler Estrogene, ein signifikant erhöhtes Risiko für Endometriumkarzinome bestimmt wurde. Für vaginale Estrogene wurde eine adjustierte Rate Ratio von 1,97 (95%-KI 1,77–2,17) errechnet. Allerdings ist bei diesen Registerdaten eine Adjustierung nach individuellen Faktoren wie BMI, Begleit- oder anamnestischen Erkrankungen nicht möglich. Diese Störfaktoren könnten sich daher wesentlich auf das Ergebnis ausgewirkt haben.
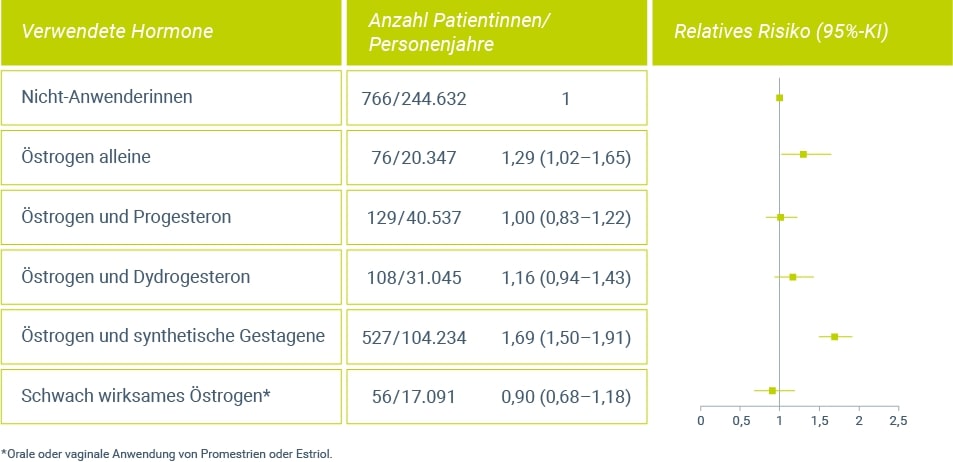
Verschiedene Daten32,33,34 belegen die weitestgehend fehlende systemische Wirkung von niedrig dosiertem (vaginalem) Estriol auf das Mammagewebe. Die Ergebnisse deuten darauf hin, dass sich Estriol hinsichtlich des Einflusses auf die Brust von anderen Estrogenen unterscheidet (Abb. 1). Weder die orale noch die vaginale Therapie mit Estriol scheint zu einer Erhöhung des Mammakarzinomrisikos zu führen.
Zur niedrig dosierten vaginalen Anwendung von Estradiol gibt es nur wenige Daten zum Brustkrebsrisiko. Aufgrund der niedrigen systemischen Spiegel ist jedoch nicht von einem starken Risikoanstieg auszugehen. Dies legt vor allem die aktuelle Auswertung der WHI-Beobachtungsstudie nahe, in welcher der Einfluss der vaginalen Estrogenbehandlung auf verschiedene Risiken wie z. B. invasives Mammakarzinom, koronare Herzerkrankungen und Mortalität untersucht wurde23. Welche Estrogene zum Einsatz kamen, wurde bei der Studie nicht abgefragt, jedoch sind in den USA vor allem vaginale Anwendungsformen mit Estradiol und CEE verfügbar. Das Risiko für ein invasives Mammakarzinom durch die lokale Anwendung von Estrogen war auf Basis zweier unterschiedlicher Auswertungsmethoden nicht erhöht.
Abbildung 1: Vergleich des relativen Brustkrebsrisikos bei Anwendung einer HRT mit unterschiedlichen Hormonen, verglichen mit Nicht-Anwenderinnen (modifiziert nach Fournier et al. 20084).
-
Sturdee, D., Panay, N., & Society, i. N. (2010). Empfehlungen zum Vorgehen bei postmenopausaler vaginaler Atrophie, 1. Oktober 2010. J Gynäkol Endokrinol, 13(4), S. 8-21.
-
Rueda, C., et al. (2017, Aug). The efficacy and safety of estriol to treat vulvovaginal atrophy in postmenopausal women: a systematic literature review. Climacteric, 20(4), pp. 321-30.
-
Luisi, M., Franchi, F., & Kicovic, P. (1980, Dec). A group-comparative study of effects of Ovestin cream versus Premarin cream in post-menopausal women with vaginal atrophy. Maturitas, 2(4), pp. 311-9.
-
Babuna, C., Aksu, M., & Rez, R. (1982). Management of lower genital tract atrophy with a vaginal cream containing oestriol. In P. Fioretti, L. Martini, G. Melis, & S. Yen (Eds.), The menopause - Clinical, endocrinological and pathophysiological aspects. Serono Symposium No. 39 (pp. 557-62). London, New York: Academic Press.
-
Van der Velden, W., Trevoux, R., & Popovic, D. (1982). Cream containing oestriol for the treatment of menopausal vaginal atrophy. In P. Fioretti, L. Martini, G. Melis, & S. Yen (Eds.), The menopause – Clinical, endocrinological and pathophysiological aspects. Serono Symposium No. 39 (pp. 535-8). London, New York: Academic Press.
-
Heimer, G. (1987). Estriol in the postmenopause. Acta Obstet Gynecol Scand Suppl, 139, pp. S1-S23.
-
Heusinger, J. (1994). Lokale Verträglichkeit von Estriol-Vaginalovula bei repetierter Applikation über 10-14 Tage. Unveröffentlichter Studienbericht KAD 41.
-
Genazzani, A., Inaudi, F., La Rosa, R., & al., e. (1982). Oestriol and the menopause – Clinical and endocrinological results of vaginal administration. Serono Symposium No. 39. In P. Fioretti, L. Martini, G. Melis, & S. Yen (Eds.). London, New York: Academic Press.
-
Mattsson, L., & Cullberg, G. (1983). Vaginal absorption of two estriol preparations. A comparative study in postmenopausal women. Acta Obstet Gynecol Scand, 62(5), pp. 393-6.
-
Henriksson, L., et al. (1994, Sep). A comparative multicenter study of the effects of continuous low-dose estradiol released from a new vaginal ring versus estriol vaginal pessaries in postmenopausal women with symptoms and signs of urogenital atrophy. Am J Obstet Gynecol, 171(3), pp. 624-32.
-
Bottiglione, F., Volpe, A., Esposito, G., & Aloysio, D. (1995, Nov). Transvaginal estriol administration in postmenopausal women: a double blind comparative study of two different doses. Maturitas, 22(3), pp. 227-32.
-
Griesser, H., et al. (2012, Apr). Low dose estriol pessaries for the treatment of vaginal atrophy: a double-blind placebo-controlled trial investigating the efficacy of pessaries containing 0.2mg and 0.03mg estriol. Maturitas, 71(4), pp. 360-8.
-
Casper, F., & Petri, E. (1999). Local treatment of urogenital atrophy with an estradiol-releasing vaginal ring: a comparative and a placebo-controlled multicenter study. Vaginal Ring Study Group. Int Urogynecol J Pelvic Floor Dysfunct, 10(3), pp. 171-6.
-
Simon, J., Nachtigall, L., Gut, R., Lang, E., Archer, D., & Utian, W. (2008, Nov). Effective treatment of vaginal atrophy with an ultra-low-dose estradiol vaginal tablet. Obstet Gynecol, 112(5), pp. 1053-60.
-
Simon, J., et al. (2017, May). A vaginal estradiol softgel capsule, TX-004HR, has negligible to very low systemic absorption of estradiol: Efficacy and pharmacokinetic data review. Maturitas, 99, pp. 51-8.
-
American College of Obstetricians and Gynecologists. (2013, Apr). ACOG committee opinion no. 556: Postmenopausal estrogen therapy: route of administration and risk of venous thromboembolism. Obstet Gynecol, 121(4), pp. 887-90.
-
Daly, E., et al. (1996, Oct). Risk of venous thromboembolism in users of hormone replacement therapy. Lancet, 348(9033), pp. 977-80.
-
Wenderlein, J. (2000). Venöse Thromboembolien. Gynäkol Geburtsh, 3, S. 42-4.
-
Scarabin, P., Oger, E., Plu-Bureau, G., & Group, E. a. (2003, Aug). Differential association of oral and transdermal oestrogen-replacement therapy with venous thromboembolism risk. Lancet, 362(9382), pp. 428-32.
-
Straczek, C., et al. (2005, Nov). Prothrombotic mutations, hormone therapy, and venous thromboembolism among postmenopausal women: impact of the route of estrogen administration. Circulation, 112(22), pp. 3495-500.
-
Baber, R., Panay, N., Fenton, A., & for the IMS Writing Group. (2016). IMS Recommendations on women's midlife health and menopause hormone therapy. Climacteric, 19(2), pp. 109-50.
-
NAMS (The North American Menopause Society). (2017, Jun). The 2017 hormone therapy position statement of The North American Menopause Society. Menopause: The Journal of The North American Menopause Society, 24(7), pp. 728-53.
-
Crandall, C., et al. (2017, Aug). Breast cancer, endometrial cancer, and cardiovascular events in participants who used vaginal estrogen in the Women's Health Initiative Observational Study. Menopause, p. doi: 10.1097.
-
Van Gorp, T., & Neven, P. (2002, Jun). Endometrial safety of hormone replacement therapy: review of literature. Maturitas, 42(2), pp. 93-104.
-
Simon, J., & Maamari, R. (2013, Aug). Ultra-low-dose vaginal estrogen tablets for the treatment of postmenopausal vaginal atrophy. Climacteric, 16(Suppl 1), pp. 37-43.
-
Lindahl, S. (2014, Mar). Reviewing the options for local estrogen treatment of vaginal atrophy. Int J Womens Health, 13(6), pp. 307-12.
-
Weiderpass, E., et al. (1999, May). Low-potency oestrogen and risk of endometrial cancer: a case-control study. Lancet, 353(9167), pp. 1824-8.
-
Ulrich, L., et al. (2010, Jun). Endometrial safety of ultra-low-dose Vagifem 10 microg in postmenopausal women with vaginal atrophy. Climacteric, 13(3), pp. 228-37.
-
Simon, J., Nachtigall, L., Ulrich, L., Eugster-Hausmann, M., & Gut, R. (2010, Oct). Endometrial safety of ultra-low-dose estradiol vaginal tablets. Obstet Gynecol, 116(4), pp. 876-83.
-
Lethaby, A., Ayeleke, R., & Roberts, H. (2016, Aug). Local oestrogen for vaginal atrophy in postmenopausal women. Cochrane Database Syst Rev, 8, p. CD001500.
-
Neves-E-Castro, et al. (2015, May). EMAS position statement: The ten point guide to the integral management of menopausal health. Maturitas, 81(1), pp. 88-92.
-
Magnusson, C., et al. (1999, May). Breast-cancer risk following long-term oestrogen- and oestrogen-progestin-replacement therapy. Int J Cancer, 81(3), pp. 339-44.
-
Lyytinen, H., Pukkala, E., & Ylikorkala, O. (2006, Dec). Breast cancer risk in postmenopausal women using estrogen-only therapy. Obstet Gynecol, 108(6), pp. 1354-60.
-
Fournier, A., Berrino, F., & Clavel-Chapelon, F. (2008, Jan). Unequal risks for breast cancer associated with different hormone replacement therapies: results from the E3N cohort study. Breast Cancer Res Treat, 107(1), pp. 103-11.
-
Moegele, M., Buchholz, S., Mueck, A., & Ortmann, O. (2016). Vaginale Östrogentherapie nach Mammakarzinom. Frauenarzt, 57(1), S. 36-46.
-
Goldhirsch, A., et al. (2013, Sep). Personalizing the treatment of women with early breast cancer: highlights of the St Gallen International Expert Consensus on the Primary Therapy of Early Breast Cancer 2013. Ann Oncol, 24(9), pp. 2206-23.
-
Partridge, A., et al. (2014, Jun). First international consensus guidelines for breast cancer in young women (BCY1). Breast, 23(3), pp. 209-20.
-
Burstein, H., et al. (2014, Jul). Adjuvant endocrine therapy for women with hormone receptor-positive breast cancer: american society of clinical oncology clinical practice guideline focused update. J Clin Oncol, 32(21), pp. 2255-69.
-
Sousa, M., et al. (2017, Apr). A clinical guide to the management of genitourinary symptoms in breast cancer survivors on endocrine therapy. Ther Adv Med Oncol, 9(4), pp. 269-85.
-
Fallowfield, L., et al. (2004, Nov). Quality of life of postmenopausal women in the Arimidex, Tamoxifen, Alone or in Combination (ATAC) Adjuvant Breast Cancer Trial. J Clin Oncol, 22(21), pp. 4261-71.
-
Lu, R., & Serrero, G. (2001, Jan). Mediation of estrogen mitogenic effect in human breast cancer MCF-7 cells by PC-cell-derived growth factor (PCDGF/granulin precursor). Proc Natl Acad Sci U S A, 98(1), pp. 142-7.
-
Vincent, A. (2015, Oct). Management of menopause in women with breast cancer. Climacteric, 18(5), pp. 690-701.
-
Le Ray, I., et al. (2012, Sep). Local estrogen therapy and risk of breast cancer recurrence among hormone-treated patients: a nested case-control study. Breast Cancer Res Treat, 135(2), pp. 603-9.
-
Donders, G., et al. (2014, Jun). Ultra-low-dose estriol and Lactobacillus acidophilus vaginal tablets (Gynoflor®) for vaginal atrophy in postmenopausal breast cancer patients on aromatase inhibitors: pharmacokinetic, safety, and efficacy phase I clinical study. Breast Cancer Res Treat, 145(2), pp. 371-9.
-
Co-ordination Group for Mutual Recognition and Decentralised procedures - Human (CMDh). (2017, Feb). CORE SmPC for Hormone Replacement Therapy Products.
-
Mørch, L., et al. (2016, Mar). The influence of hormone therapies on type I and II endometrial cancer: A nationwide cohort study. Int J Cancer, 138(6), pp. 1506-15.